Aplicaciones
Resumen: Las Aplicaciones de los compuestos de coordinación son numerosas, pues se utilizan como colorantes, medicamentos, catalizadores, secuestradores metálicos, quelatantes, vitaminas, conductores, en analítica etc. En esta sección se describen algunas de sus aplicaciones.
Análisis
La formación de compuestos de coordinación, y en especial de quelatos, tiene gran aplicación en la determinación cualitativa y cuantitativa de diversos iones metálicos debido a la gran estabilidad que presentan los compuestos formados. Uno de los agentes quelatantes más utilizado es el EDTA, que se usa para determinaciones volumétricas de iones tales como Ca2+ y Mg2+, los cuales pueden determinarse uno en presencia del otro.
Bajo el nombre genérico de Titriplex se venden diversos agentes quelatantes:
- Titriplex I: Ácido nitrilotriacético, poco soluble en agua y soluble en álcalis.
- Titriplex II: Ácido etilendiaminotetraacético (EDTA). Difícilmente soluble en agua, fácilmente soluble en álcalis.
- Titriplex III: Sal disódica del EDTA. Fácilmente soluble en agua, con reacción ácida.
- Titriplex IV:Ácido ciclohexadiamin-(1,2)-tetraacético, poco soluble en agua y soluble en álcalis
La formación de complejos se utiliza también en determinaciones gravimétricas, tales como la de Ni2+ con DMG
Aplicaciones industriales
Secuestro de iones metálicos
En muchos procesos industriales la presencia de iones metálicos extraños causa problemas debido a que pueden tener efectos adversos en la calidad del producto. Para reducir al mínimo la cantidad de ion metálico libre se utilizan agentes quelatantes del mismo tipo de los usados en química analítica, que también se conocen como agentes secuestrantes. Los iones metálicos pueden ser nocivos en la industria textil (en el blanqueo y teñido, al formarse sales metálicas poco solubles), en las calderas (por formación de sedimentos o depósitos que se adhieren a ellas), en la estabilidad de grasas y aceites (al catalizar su oxidación). En la industria, hay tres tipos de agentes secuestrantes que se usan preferentemente:
- 1. Polifosfatos.
- 2. Ácidos aminopolicarboxílicos.
- 3. Algunos ácidos hidroxicarboxílicos.
Los polifosfatos
Son ampliamente utilizados como aditivos en jabones y detergentes por su capacidad de formar complejos hidrosolubles con iones como el calcio y el magnesio. La principal desventaja de los polifosfatos es su tendencia a sufrir hidrólisis o reversión, dando ortofosfato, lo cual disminuye su capacidad de formación de quelatos. Hay dos efectos ambientales adversos con relación al uso de fosfatos: la eutrofización de los lagos y la contribución al desarrollo de algas. El EDTA, un ácido aminopolicarboxílico, tiene muy diversos usos, entre otros, la eliminación de depósitos de calderas y en la industria de jabones y detergentes ya que forma complejos muy estables al calentamiento y en medio alcalino con iones como el calcio y el magnesio.
Los ácidos hidroxicarboxílicos
Los ácidos hidroxicarboxílicos más usados industrialmente son los ácidos glicónico y cítrico, y en menor grado, el tartárico y el sacárico. Estos ácidos se utilizan en la limpieza de metales, en la estabilización de frutas congeladas pues evita la oxidación del ácido ascórbico (catalizada por metales), y en procesos de electrodeposición. Los complejos de los ácidos hidroxicarboxílicos son menos estables que los de los ácidos aminopolicarboxílicos, en especial en soluciones de pH inferior a 11. Sin embargo, a pH superiores los primeros se ionizan produciendo los aniones que son mejores ligantes que los ácidos.
Extracción y separación de metales
La extracción y purificación de metales de los minerales puede hacerse por procesos hidrometalúrgicos y por extracción con solventes, que son generalmente agentes quelatantes. Por ejemplo, el Cu se extrae de los licores de lixiviación amoniacal de minerales de cobre mediante intercambiadores iónicos líquidos. El primer compuesto usado comercialmente para este metal fue el LIX 63, 5,8-dietil-7-hidroxidodecano-6-oxima, el cual puede utilizarse para separar el Cu a pH superior a 4. De soluciones más ácidas, el Cu puede extraerse mediante el LIX 64, el cual tiene un hidróxido fenólico y un grupo oxima. Después, el metal se extrae nuevamente en fase acuosa mediante tratamiento con H2SO4 diluido.
5,8-dietil-7-hidroxidodecano-6-oxima
Colorantes
La mayoría de los colorantes son compuestos orgánicos que contienen grupos cromóforos. Sin embargo, algunas de sus propiedades pueden mejorarse con iones metálicos. Por ejemplo, la estabilidad a la luz de los colorantes diazoícos es mayor cuando se forman complejos de cobre. Un grupo muy importante de pigmentos y colorantes sintéticos está constituido por los complejos de ftalocianinas con metales tales como Cobre, Níquel, Hierro y Cobalto.
Catálisis
En este caso los metales de transición proveen un sitio donde el paso determinante de una reacción puede ocurrir más fácilmente que en ausencia del catalizador. Gran cantidad de procesos industriales son catalizados por compuestos organometálicos. Dentro de estos se tienen los siguientes.
1. Hidrogenación de olefinas
Se usan como catalizadores en compuestos de metales en bajos estados de oxidación, tales como el Rh. Por ejemplo el catalizador de Wilkinson, [RhCl(PPh3)3]
H2C=CH2 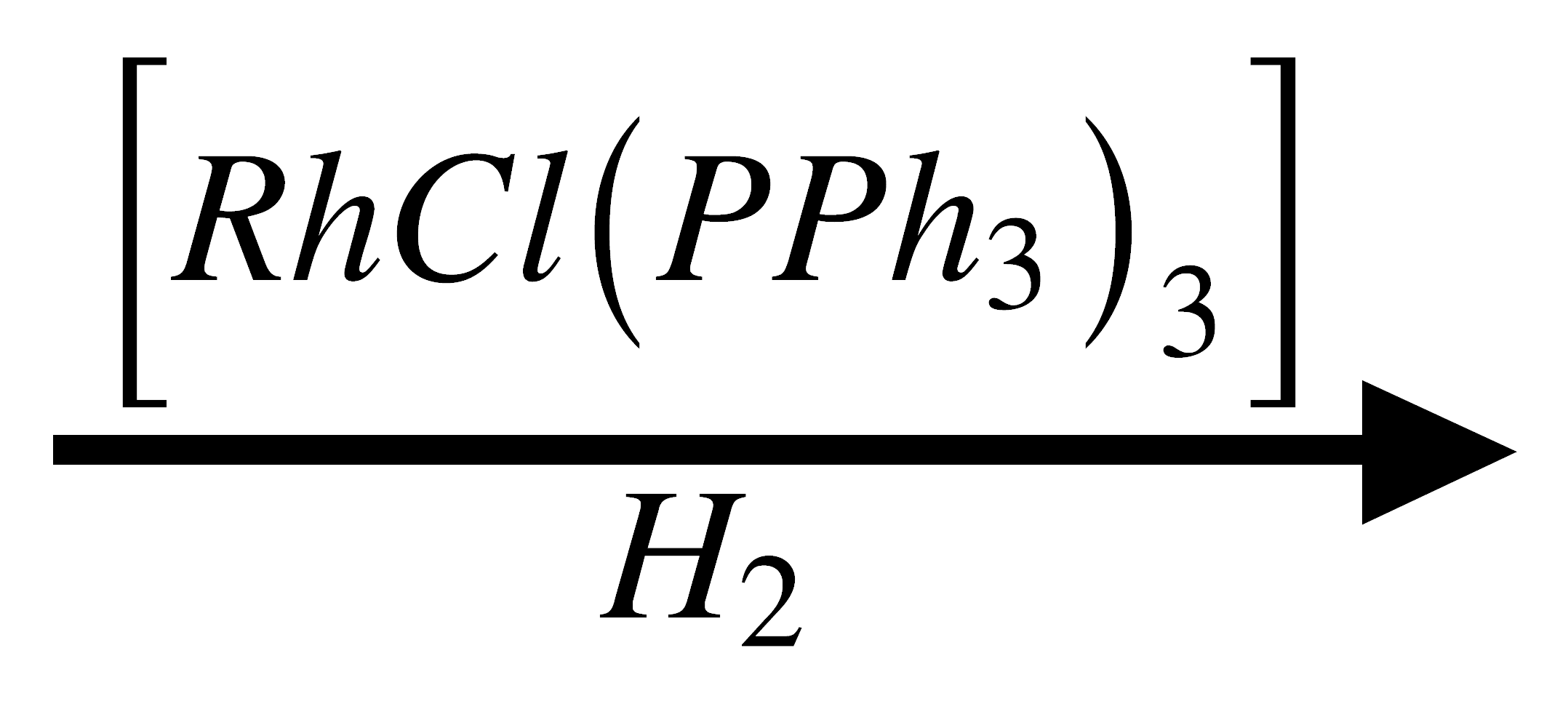 CH3-CH3
CH3-CH3
En presencia del catalizador, la reacción puede llevarse a cabo a 25°C y 1 atm.
2. Hidroformilación de olefinas
Es la adición de H2 y CO a una olefina para formar un aldehído. Se conoce como el proceso oxo. El proceso clásico utiliza [Co2(CO)8] como catalizador, a 150-180°C y 200-400 atm.
RCH=CH2 + H2 + CO  RCH2CH2CHO
RCH2CH2CHO
El proceso se lleva a cabo más efectivamente a 100°C y pocas atmósferas de presión utilizando el complejo [Rh CO(PPh3)2]
3. Oxidación de olefinas a aldehídos y cetonas:
Un proceso utilizado industrialmente es el Wacker, el cual consiste en la oxidación de etileno a acetaldehído en presencia de un catalizador de Pd (II).
H2C=CH2 + ½O2 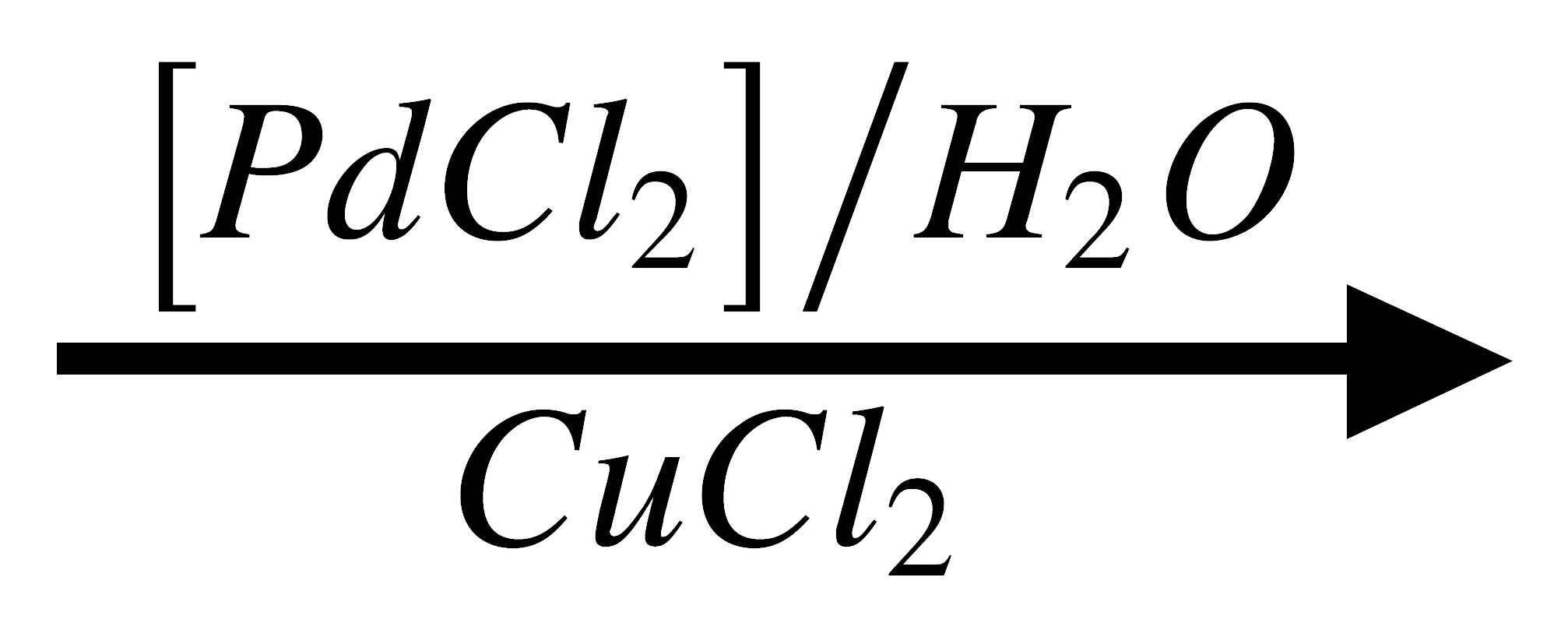 CH3CHO
CH3CHO
4. Polimerizaciones
Uno de los procesos más conocidos es la polimerización de propileno, utilizando el catalizador de Ziegler-Natta, que da polímeros estereo-regulares. El catalizador es una mezcla de TiCl4 y AlEt3.
5.Ciclooligomerización de olefinas o acetilenos:
La reacción de Reppe consiste en la formación de derivados de ácidos carboxílicos a partir de olefinas o acetilenos utilizando carbonilos metálicos como catalizadores
HCCH + CO + H2O
4].png) H2C=CHCOOH
H2C=CHCOOH
6. Isomerización de olefinas
La migración de dobles enlaces en olefinas es catalizada por carbonilos de Co o Ni. Por ejemplo, la isomerización del alcohol alílico a propionaldehído catalizada por H[Co(CO)4].
CH2=CHCH2OH
4].png) CH3CH=CHOH
CH3CH=CHOH
 CH3CH2CHO
CH3CH2CHO
Medicina
La gran mayoría de los metales pesados son tóxicos. Los mecanismos de toxicidad son diversos, pero todos se basan en la capacidad de coordinación de los iones metálicos a las biomoléculas. A pesar de esta toxicidad, varios iones tienen aplicaciones terapéuticas, entre las cuales se pueden mencionar las siguientes.
1. Tratamiento del cáncer
El compuesto más ampliamente usado es el cis-platino.
La acción del compuesto es estereoselectiva, por lo tanto el isómero trans no presenta acción anticancerígena. El compuesto actúa por coordinación del ion metálico a ciertas bases del DNA. Se han ensayado además otros complejos de Pt y de otros metales (Rh), pero no son tan efectivos o presentan una citotoxicidad muy alta, con excepción del carboplatino, el complejo de segunda generación más utilizado en este tratamiento.
2. Tratamiento de la artritis
Desde hace aproximadamente 50 años se han utilizado compuestos de Au(I) en el tratamiento de la artritis reumatoidea. El oro normalmente se administra en forma de complejo, en el cual el metal está coordinado a átomos de S, por ejemplo Na3[Au(S2O3)2].
El problema que presentan estas drogas son las reacciones colaterales altas y la acumulación del metal, con posible daño en los riñones.
3. Tratamiento de envenenamientos
Los metales pesados tienen tendencia a acumularse en los riñones y el hígado. Generalmente estos metales se unen a moléculas para formar complejos. A medida que pasa el tiempo, se van formando complejos cada vez más estables, lo que es importante en el tratamiento del envenenamiento crónico.
El procedimiento más normal en el caso de intoxicaciones por metales es utilizar un agente quelante para formar un complejo que sea soluble en agua y así pueda excretarse por la orina. Obviamente los agentes quelatantes que pueden utilizarse deben cumplir ciertas condiciones. Por ejemplo. el Hg(II) puede eliminarse mediante tratamiento con ligantes que tengan grupos sulfhídrico, como el ácido 2,3-dimercaptosuccínico.
En conclusión, cada vez es mayor el uso de los iones de transición y de sus compuestos de coordinación. Se puede decir que ellos intervienen en la mayoría de los procesos industriales y biológicos, bien sea como materias primas, en los procesos mismos o como productos finales.