Modelo de Lewis
Gilbert N. Lewis
Nacimiento: 25 de octubre de 1875, Weymouth, Massachusetts
Fallecimiento: 23 de marzo de 1946, Berkeley, California
Gilbert N. Lewis fue la persona principalmente responsable por el establecimiento y consolidación de la reputación internacional del Departamento de Química de Berkeley como uno de los mejores en el mundo. Realizó sus estudios en Harvard, Universidad de la cual obtuvo un Ph.D en 1899.

Fotografía de Lewis [1]
Lewis es reconocido por su modelo del enlace covalente y su concepto de los pares de electrones; sus estructuras de Lewis y otras contribuciones han dado forma a las teorías modernas de los enlaces químicos. Además aportó a la termodinámica, la fotoquímica y la separación de isótopos, y es también conocido por su concepto de ácidos y bases. Lewis propuso su modelo de átomo en 1916 y a la vez pudo explicar de una manera sencilla el enlace químico como un par de electrones que mantiene unidos a dos átomos. El fundamento del modelo son los pares electrónicos; la estabilidad de los compuestos se explica porque completan 8 electrones en su capa más externa. Con respecto a los compuestos de coordinación, Lewis postuló que:
Los grupos que están unidos al ion metálico, conformando la entidad de coordinación, poseen pares libres de electrones, es decir, no están compartidos en un enlace, El número de coordinación es aquel que indica el número real de pares de electrones que están unidos al átomo metálico.
En otro aspecto de su teoría, Lewis propuso una definición más general para ácidos y bases, en la cual una base es aquella que tiene un par libre de electrones que puede donar a otro átomo, mientras que un ácido es la sustancia que puede aceptar un par libre de electrones para formar un enlace. En este sentido, el ion metálico en un complejo es un ácido de Lewis y los grupos que están unidos a este ion en la entidad de coordinación son bases de Lewis. En este sentido, los siguientes grupos iónicos o moleculares, entre muchos otros, pueden actuar como bases de Lewis y unirse a un ion metálico:
Acuo
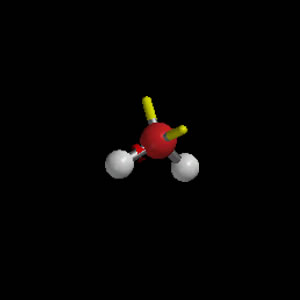

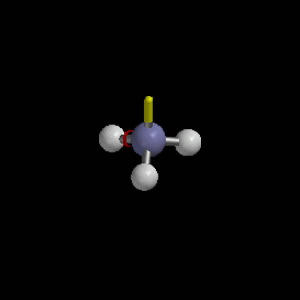
Ammino

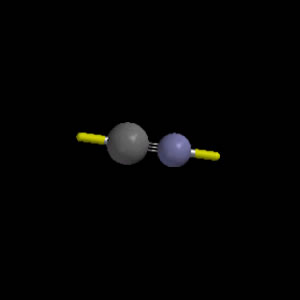
Cloro

Ciano
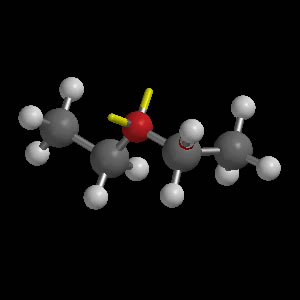
Dietiléter
Con base en este modelo algunos autores hacen una diferencia entre el enlace covalente propiamente dicho, en donde se supone que cada átomo comprometido aporta un electrón para formar el enlace por par electrónico, y el enlace de coordinación, en donde se propone que sólo uno de los átomos comprometidos en el enlace aporta el par de electrones. Si bien esta diferenciación ayuda a entender el origen del enlace, una vez formado el compuesto de coordinación ya no tiene sentido, puesto que los enlaces son equivalentes.
El caso más sencillo para ilustrar lo anterior es el del H3N y el H3N-H+ o mejor NH4+, en el que se podría pensar que este último enlace es de coordinación y en algunos textos hasta se llega a representar como H3 N→ H+. Sin embargo, el ion NH4+ es un tetraedro regular, en el que todos los cuatro enlaces son equivalentes y por lo tanto son imposibles de diferenciar.
Otros ejemplos
Hidroxo
Etoxo
Etanol
Etilendiamina
Hexaacuacobalto(II)
.jpg)