Propiedades espectroscópicas
Resumen: El gran éxito de la Teoría del Campo Cristalino TCC fue que pudo explicar el color de los compuestos de coordinación. El color tiene que ver con la región visible del espectro electromagnético. La espectroscopía visible, junto con la ultravioleta tiene su origen en la excitación o salto de los electrones de valencia, por lo que es conocida también como espectroscopía electrónica. Para facilitar la discusión de la TCC se presenta primero un resumen sobre espectroscopía en general.
Los métodos espectroscópicos comúnmente usados para medir las propiedades de los enlaces tienen como base el hacer incidir radiación electromagnética sobre la molécula a estudiar.
M + hv  M*
M*
Las técnicas utilizadas reciben el nombre de la región del espectro a la cual pertenece la radiación incidente. En la espectroscopia se consideran las siguientes: Ultravioleta, visible e infrarroja. La información que de ellas se obtiene depende de los cambios inducidos sobre la materia por la energía de la radiación.
Al irradiar una molécula se induce una transición que en forma aproximada puede considerarse que ocurre desde los niveles de energía más altos ocupados, hasta los de menor energía desocupados (HOMO y LUMO, respectivamente). En una forma más precisa, las transiciones ocurren entre estados energéticos por interacciones electrónicas.
La energía de un átomo o molécula depende de los orbitales del sistema que tienen densidad electrónica. La separación entre estos niveles electrónicos es grande, del orden de KJ/mol y las espectroscopías visible y UV operan a frecuencias que corresponden a la energía de transiciones electrónicas del estado fundamental molecular a estados excitados.
Las moléculas tienen además otras clases de energía, la longitud de enlace de una molécula no es constante, sino que sufre vibraciones similares a las de dos masas conectadas por un resorte, las cuales dan lugares a diferentes niveles energéticos vibracionales cuya separación es de unos pocos KJ/mol. La espectroscopia IR induce transiciones entre estos niveles vibracionales.
La siguiente tabla resume los principales aspectos de los tres tipos de espectroscopia de absorción mencionadas:
| Región | Longitud de onda l (m) | Número de onda n (cm-1) | Energía (KJ/mol) | Cambio inducido |
| UV | 3.5x10-7 a 2x10-8 | 50000 - 28500 | 103 - 104 | Transiciones electrónicas |
| VIS | 8x10-7 a 3.5x10-7 | 28500 - 12500 | 102 - 103 | Transiciones electrónicas |
| IR | 2x10-4 a 8.0x10-7 | 12500 - 50 | 1 - 50 | Vibraciones del enlace |
Espectroscopia infrarroja
Para que haya una transición en el IR debe haber un cambio en el momento dipolar de la molécula (ya sea en su magnitud o en su localización), el cual se produce al inducir vibraciones en el enlace. La frecuencia de las vibraciones puede obtenerse fácilmente por medio de la ley de Hooke:
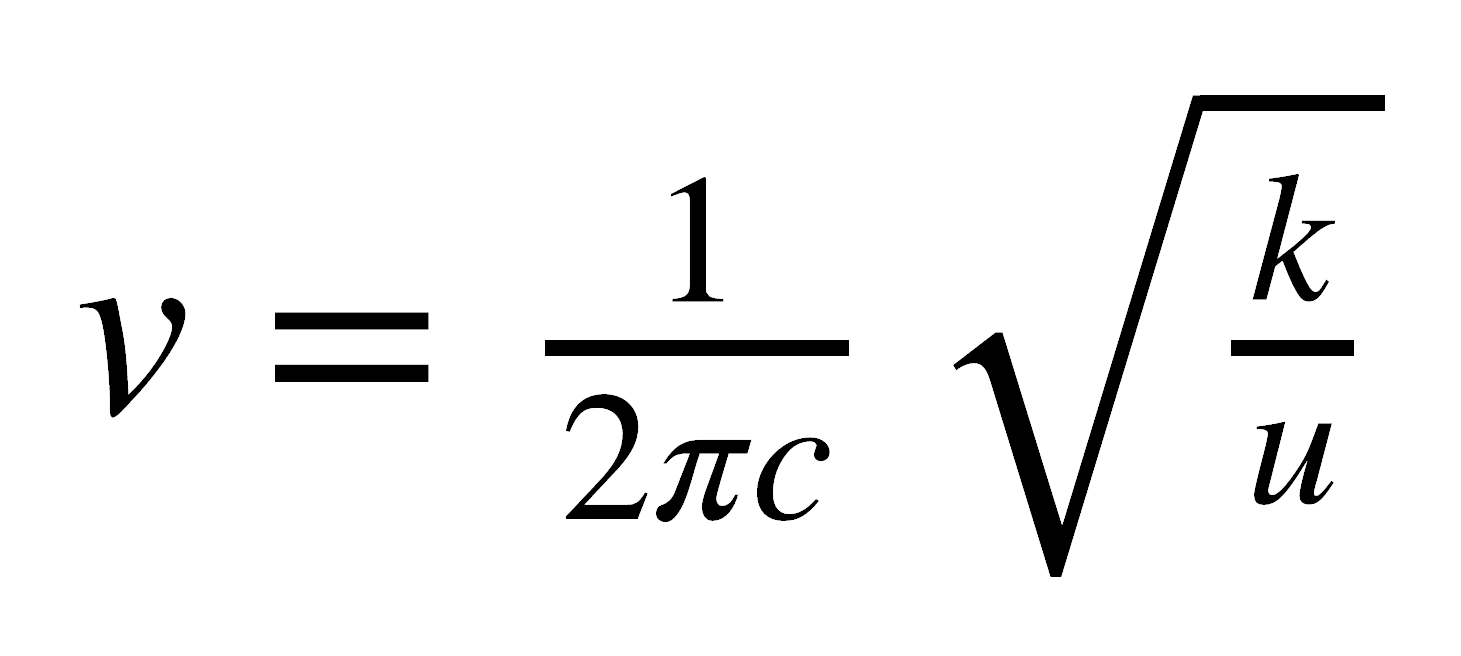
donde n es la frecuencia de la vibración, m es la masa reducida, k es la constante de fuerza para el enlace y c es la velocidad de la luz.
Es decir, las frecuencias de las transiciones vibracionales están determinadas por las masas de los átomos constituyentes, la geometría molecular y las fuerzas interatómicas. La constante k se relaciona con la fuerza del enlace, por consiguiente aumenta con el orden de enlace, es decir, es mayor para un triple enlace que para uno doble, y a su vez esta es mayor que para uno sencillo. Así mismo, se observa que a medida que las masas de los átomos aumentan, aumenta la masa reducida y por lo tanto disminuye la frecuencia de vibración. Se concluye entonces que los átomos más pesados vibran a menores frecuencias.
Por otra parte, el estado de oxidación de un grupo es el factor más importante para predecir la frecuencia de absorción. Como regla general, a medida que aumenta la carga en el átomo central, el átomo se hace más electronegativo, entonces la constante de fuerza aumenta y por lo tanto la frecuencia de absorción también aumenta. Entre mayor sea la diferencia de electronegatividades de los átomos que forman el enlace, mayor será la frecuencia de absorción.
En forma general, puede decirse que en los complejos metálicos pueden presentarse vibraciones que se originan en el ligante (4000 ‑ 650 cm-1) y otras a menor frecuencia que se originan en los enlaces metal-ligante (650 ‑ 50 cm-1).
Espectroscopia ultravioleta visible
Una gran cantidad de compuestos inorgánicos, en especial los de los metales de transición, absorben en la región visible del espectro y por lo tanto aparecen coloreados. El color de un compuesto depende del color transmitido, el cual es el complemento del color absorbido. Los fundamentos teóricos de los métodos espectrofotométricos de absorción están dados por la ley de Beer:
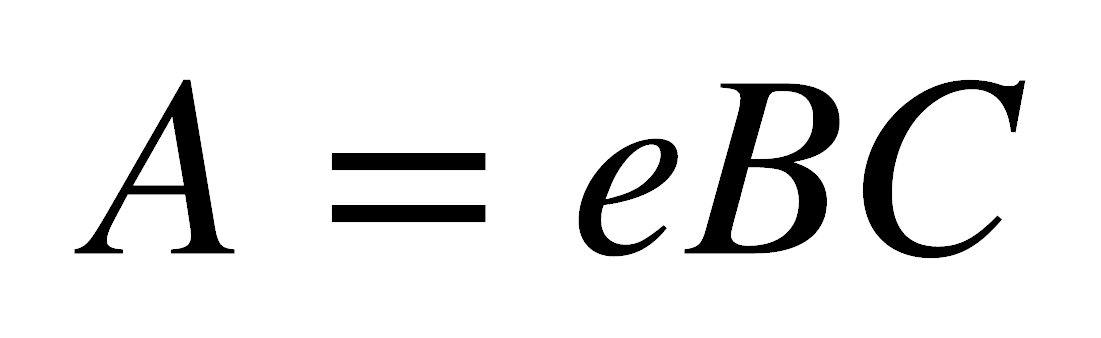
donde A es la absorbancia, e es el coeficiente de absortividad molar (L mol-1 cm-1), B es la longitud del paso de luz (cm) y C es la concentración de la muestra.
En un espectro una banda de absorción se caracteriza por su posición y su intensidad. Por consiguiente, los espectros registrados son generalmente una gráfica de A vs. l ó n de absorción, pero con frecuencia los datos se convierten a e vs. l. El uso de la absortividad molar como la unidad de intensidad de absorción tiene la ventaja de que todos los valores se refieren al mismo número de especies absorbentes.
El coeficiente de absortividad molar es característico para cada sustancia y su valor depende de que la transición a la cual corresponde sea permitida o prohibida según ciertas reglas de selección. Sin embargo, en un espectro pueden observarse las transiciones prohibidas porque las reglas se rompen en alguna forma. La intensidad de las transiciones permite diferenciarlas, puesto que las transiciones permitidas tienen valores de e entre 1000 y 100000 L mol-1 cm-1, y las prohibidas, entre 1 y 50.
Las reglas de selección que limitan la ocurrencia de las transiciones electrónicas están gobernadas fundamentalmente por la simetría. En líneas generales y de una manera muy sencilla éstas son:
-
Una transición es permitida cuando el producto directo de las representaciones de las funciones de onda vibracionales o electrónicas que describen los niveles involucrados en la transición y del eje de coordenadas que representa la dirección del vector eléctrico de la luz, contiene la representación totalmente simétrica. En una forma matemática, esto puede representarse mediante la ecuación:
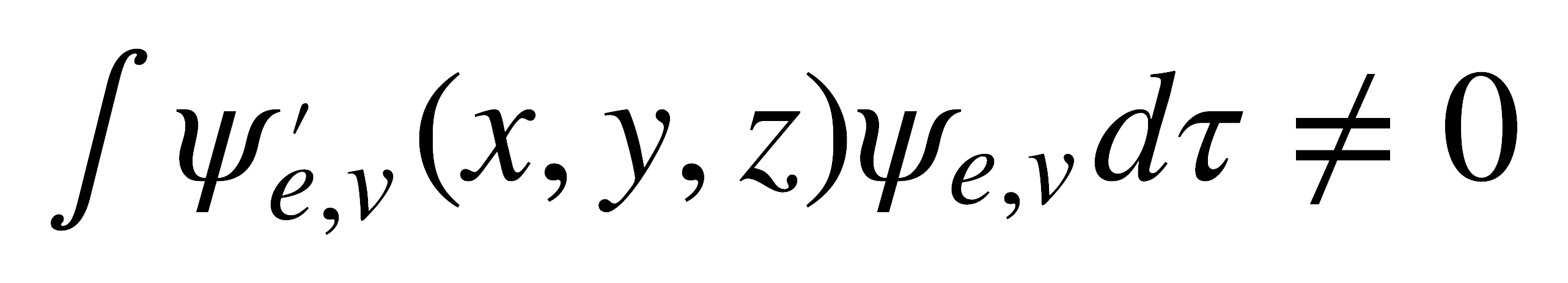
En términos de simetría la ecuación anterior indica que la integral debe contener la representación totalmente simétrica. El entendimiento de esta formulación requiere un conocimiento más profundo de la teoría de grupo, pero en una forma aproximada puede establecer que no se permiten transiciones entre estados que tengan la misma denominación de simetría. Por ejemplo, en una forma aproximada, la transición 3A2 -> 2A2 es prohibida. Debe entenderse que, al tratarse de una primera aproximación, esta formulación no siempre es correcta.
-
Sólo se permiten transiciones entre estados que tengan la misma multiplicidad de espín (es decir, el número de electrones desapareados no debe cambiar por una transición electrónica).
-
Si la molécula tiene centro de simetría entonces están prohibidas las transiciones de un orbital centro simétrico a otro. Es decir, sólo son permitidas las transiciones g->u o u->g.
-
Regla de Laporte: las transiciones electrónicas deben efectuarse con cambio de 1 en el momento angular orbital, Δl = ±1. Por esta razón, son prohibidas las transiciones s->s, p->p, d->d.
-
Sólo se permiten transiciones de un electrón.
Las transiciones electrónicas implican un desplazamiento de la densidad de carga; con base en esto, las que se observan en las regiones visible y ultravioleta pueden ser de dos tipos:
Transiciones de campo ligando, o d‑d: Se presentan específicamente en los compuestos de coordinación. Se explican por transiciones entre orbitales del ion central que tienen fundamentalmente carácter d, y por lo general se encuentran en la región visible y en el cercano IR del espectro, por lo tanto son las que fundamentalmente explican el color en estos compuestos. Las bandas son generalmente anchas y débiles porque formalmente son transiciones prohibidas. Proporcionan información acerca de la estructura electrónica y geométrica del ion metálico.
Transiciones de transferencia de carga: En este caso, el desplazamiento ocurre entre orbitales cuyo mayor carácter corresponde a dos átomos diferentes. Estas transiciones son formalmente permitidas y por lo tanto son más intensas que las de campo ligando. Por otra parte, se presentan a mayor energía que las anteriores, luego generalmente se localizan en las regiones visible y UV del espectro. Las transiciones de transferencia de carga se presentan en las sales sencillas y pueden tomarse como una medida del carácter del enlace, puesto que a medida que aumenta el carácter covalente del enlace, estas transiciones se desplazan de la región ultravioleta a la visible. En otras palabras, hay una correlación estrecha entre el porcentaje de carácter iónico de las sustancias. Con pocas excepciones, las sustancias incoloras son aquellas que tienen más del 20 % de carácter iónico; además para átomos electronegativos, el color se hace más intenso a medida que disminuye el carácter iónico, desde amarillo y naranja hasta negro y rojo. Por otra parte, para átomos electropositivos un aumento en el carácter covalente del enlace ocasiona un desplazamiento de las bandas hacia el violeta.
De la interpretación de los espectros visible-ultravioleta de los compuestos de coordinación puede extraerse información acerca del número de coordinación, la estereoquímica y la carga efectiva del metal. El efecto de los anteriores parámetros depende del tipo de transición que presente. En los compuestos de coordinación, pueden distinguirse por lo menos tres tipos de transiciones de transferencia de carga:
- Transiciones intraligante: son transiciones internas entre los diferentes átomos de un ligante. Por ejemplo, las que suceden en el SCN-, o en los ligantes orgánicos con dobles enlaces conjugados (n* -> π*, etc.).
- Transiciones L -> M: son transiciones en las cuales un electrón se transfiere de un orbital con mayor carácter de ligante a un orbital con mayor carácter de metal, y por lo tanto se reduce la diferencia de carga en el complejo. Estas transformaciones se presentan a menos energía cuando los ligantes son fácilmente oxidables (I-, S2-) o cuando los metales están en sus estados de oxidación más altos y por lo tanto son fácilmente reducibles.
- Transiciones M -> L: el electrón se transfiere de un orbital con carácter metálico a uno con carácter de ligante. Por lo tanto, estas bandas se presentan a menor energía cuando el estado de oxidación del metal es bajo o cuando el ligante es más electronegativo; en otras palabras, cuando el metal es fácilmente oxidable y el ligante es fácilmente reducible.