Propiedades magnéticas
Resumen: Las teorías del Enlace Valencia TEV y del Campo Cristalino TCC (capítulo final) aplicadas al Enlace de Coordinación TEC, se desarrollaron no solo para explicar el enlace de coordinación sino también las propiedades de los metalocompuestos, dentro de ellas su comportamiento magnético. Por lo tanto, para facilitar su discusión se presenta primero una visión general sobre magnetismo.
Paramagnetismo y diamagnetismo
Los efectos magnéticos en una molécula se originan principalmente por el movimiento de los electrones, ya que el momento magnético de un electrón es aproximadamente 1000 veces el de un protón. La presencia de electrones móviles en los átomos garantiza que casi toda la materia interactúa con un campo magnético aplicado. Casi todos los compuestos de los grupos principales tienen orbitales llenos con espines electrónicos completamente apareados, por lo tanto no hay momento angular ni de espín netos para estas moléculas.
A pesar de esto, la aplicación de un campo magnético hace que los electrones induzcan un pequeño campo magnético que se opone al campo aplicado. Este comportamiento se conoce como diamagnetismo, y es característico de las sustancias que tienen sus electrones apareados. Experimentalmente el diamagnetismo se detecta porque al colocar la sustancia entre los polos de un electroimán, parece pesar menos que en ausencia del campo, ya que es repelida por éste. El diamagnetismo es independiente de la temperatura y su estudio no da demasiados indicios acerca de la naturaleza del enlace o de la estructura de una sustancia.
Sin embargo, si los compuestos presentan electrones desapareados, la situación es muy diferente. Un electrón desapareado tiene un momento angular de espín neto y puede tener un momento angular orbital, que dan lugar a un momento magnético. Este momento magnético refuerza el campo magnético aplicado, al orientarse en forma paralela al campo aplicado:
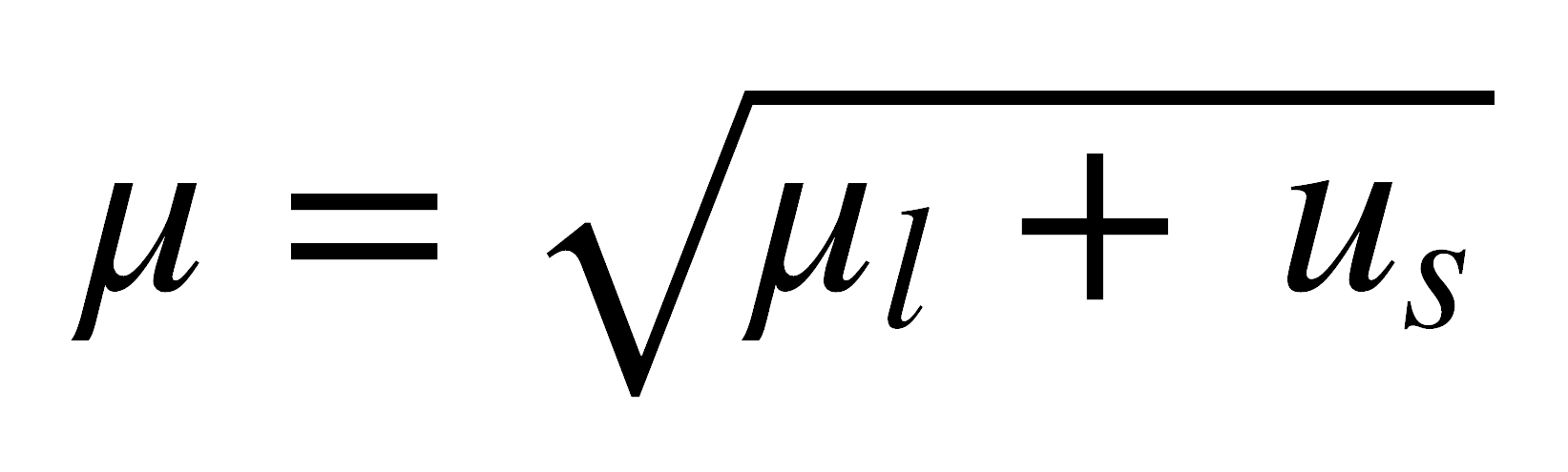
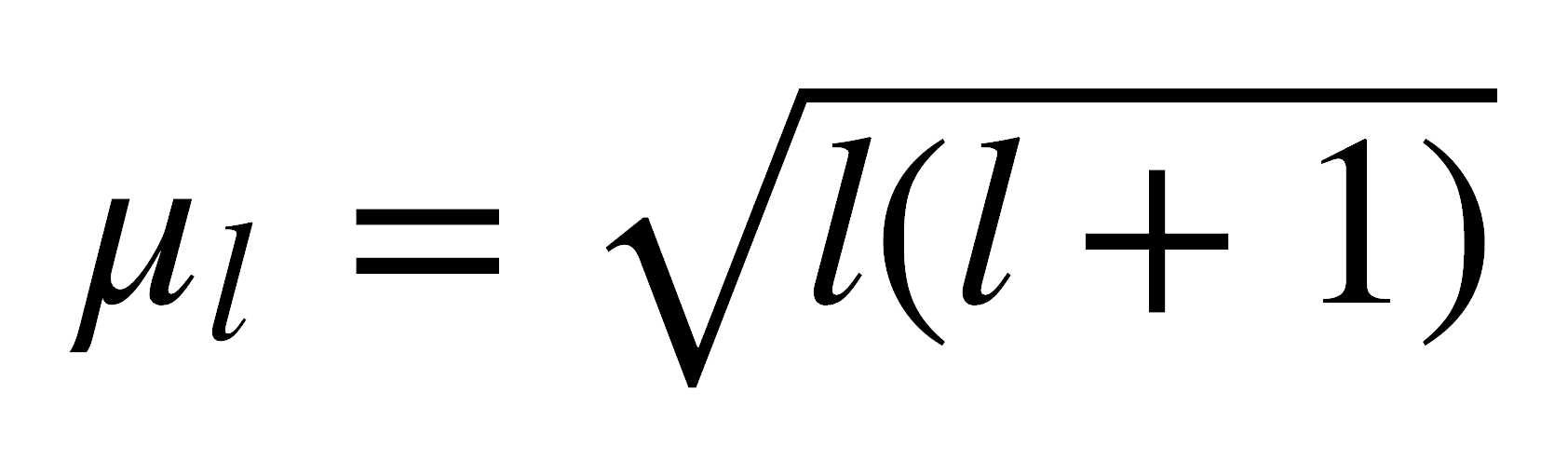
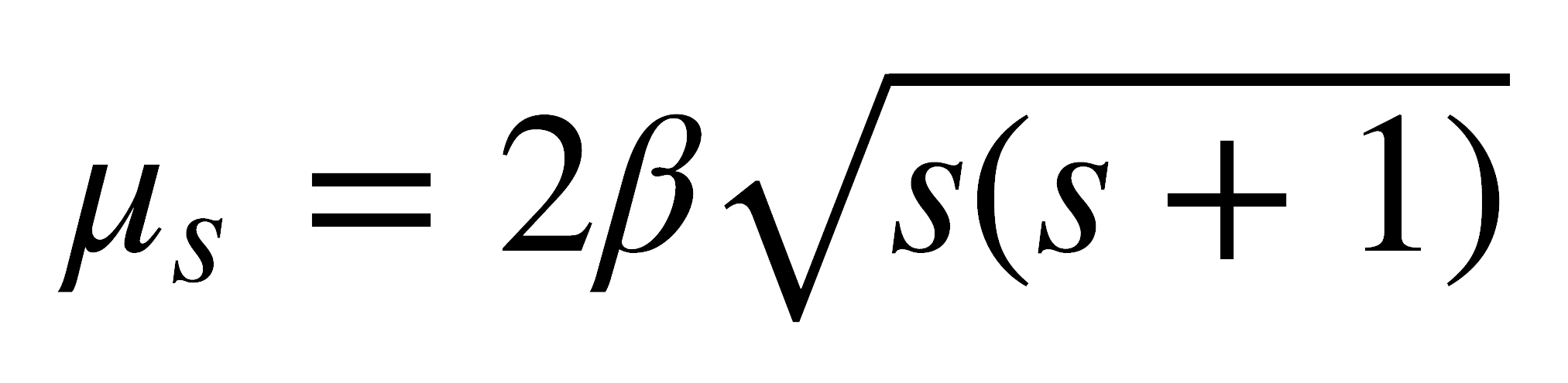
donde ml es el momento magnético orbital, ms es el momento magnético de espín, β es el magnetón de Bohr (unidad natural para el momento magnético), equivalente a 9,274 x 10-24 JT-1.
Una muestra con estas propiedades es paramagnética y se reconoce experimentalmente porque es atraída por un campo magnético aplicado. Al colocarla entre los polos de un electroimán, parece que pesara más que en ausencia del campo. En los metales de transición, el estudio del paramagnetismo es de particular interés, porque da información acerca de la configuración electrónica de los iones. A continuación se presenta un breve resumen de la teoría del magnetismo.
Cuando una sustancia se coloca en un campo magnético H, el campo dentro de la sustancia, B, es generalmente diferente a H y se relacionan entre sí de la siguiente forma:
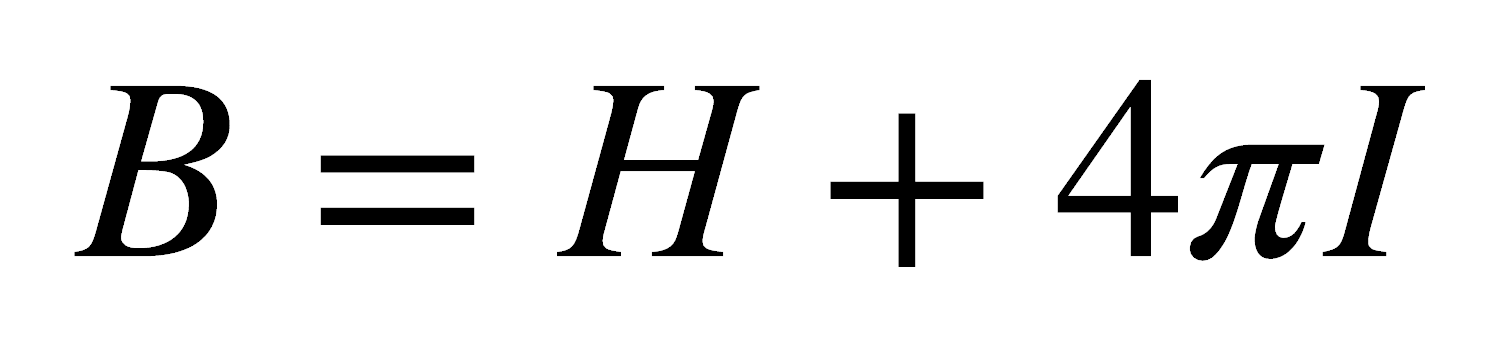
donde 4πI es el campo inducido dentro de la muestra e I es la intensidad de magnetización y es igual al momento magnético inducido por unidad de volumen. La ecuación puede escribirse:
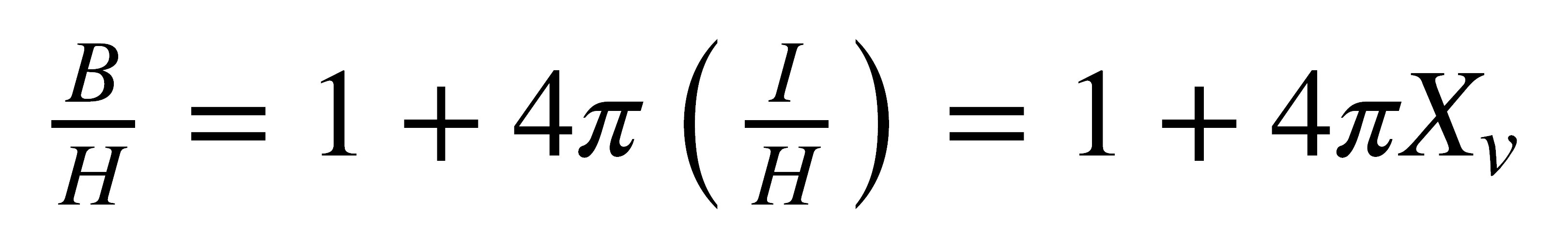
Para las sustancias diamagnéticas, I y cv (susceptibilidad magnética por unidad de volumen) tienen valores negativos, mientras que para las sustancias paramagnéticas, estos valores son positivos.
El cambio en peso de la muestra en presencia de un campo magnético es el parámetro que se mide en los dos métodos experimentales para determinar el campo magnético, el de la balanza de Gouy y el de la balanza de Faraday. El cambio en peso se relaciona directamente con la susceptibilidad magnética por unidad de volumen, por una ecuación que depende del método usado. Sin embargo, es más conveniente utilizar la susceptibilidad por gramo, o susceptibilidad específica, cg, que se relaciona con cv así:
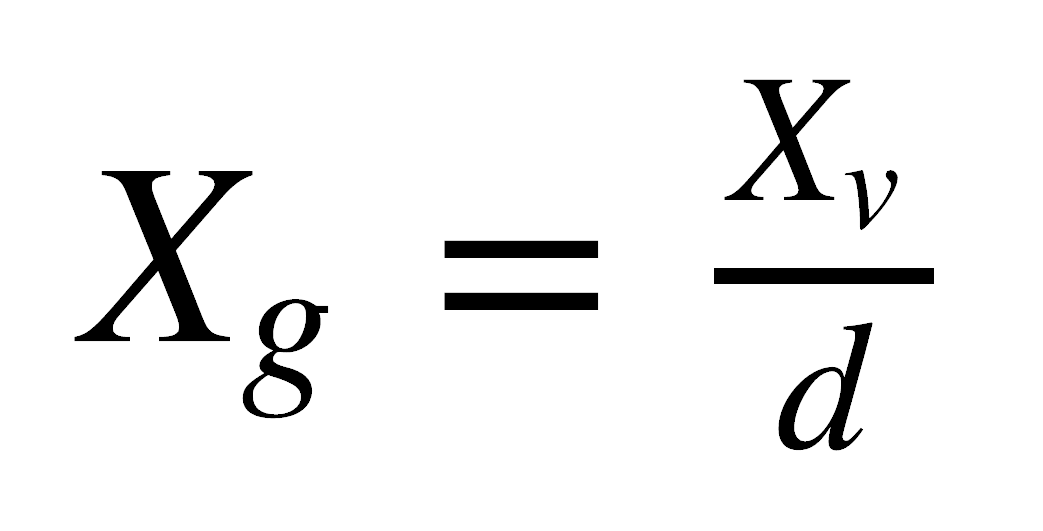
donde d es la densidad de la muestra.
Para poder relacionar las propiedades magnéticas con las propiedades atómicas, convertimos cg en cM, la susceptibilidad molar, cuyas unidades son cm3 mol-1:
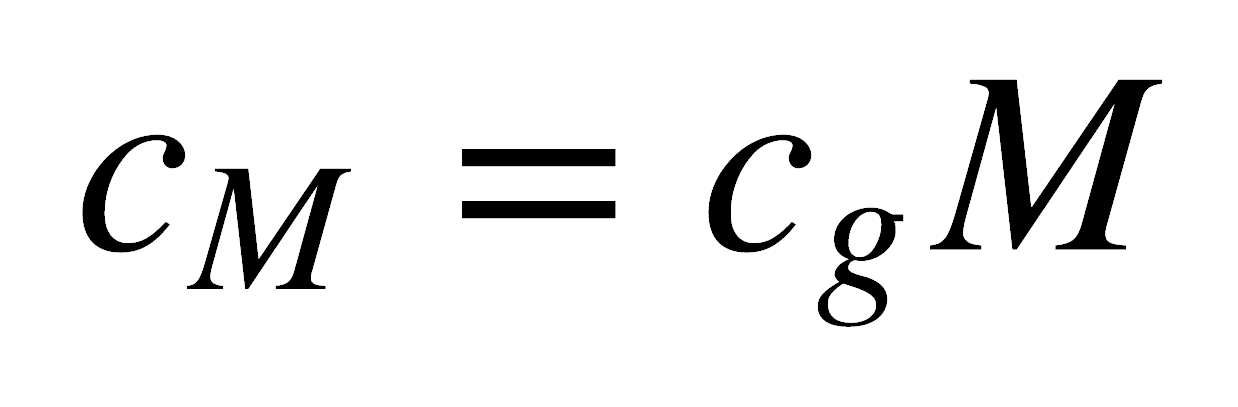
donde M es el peso molecular. M incluye el diamagnetismo de los electrones apareados, entonces es necesario sustraer de cM la contribución diamagnética para obtener únicamente la susceptibilidad paramagnética, c:
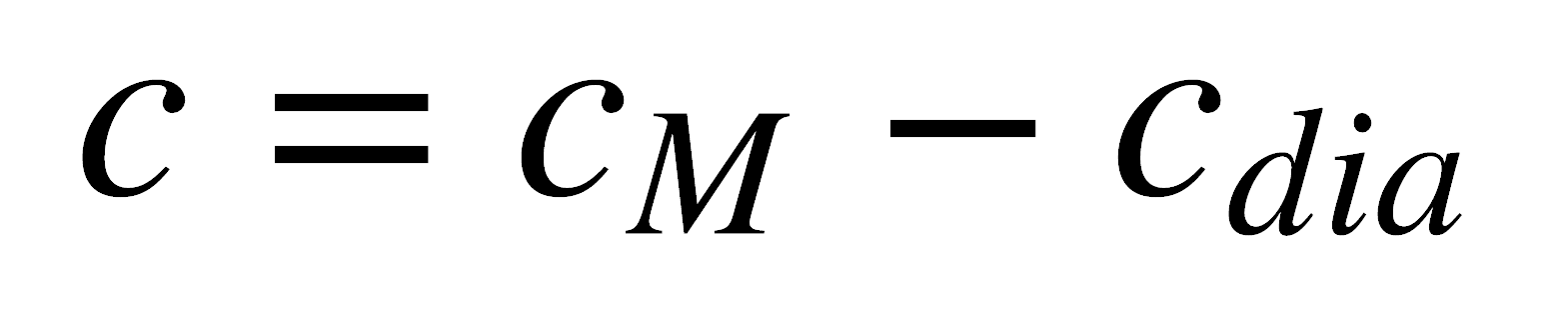
En una buena aproximación, cdia es simplemente la contribución diamagnética de cada átomo más la de ciertas clases de enlaces presentes. Estas contribuciones pueden encontrarse tabuladas como las constantes de Pascal.
Lo único que queda por hacer es relacionar c con el momento magnético, lo cual puede hacerse a través de la ley de Curie:
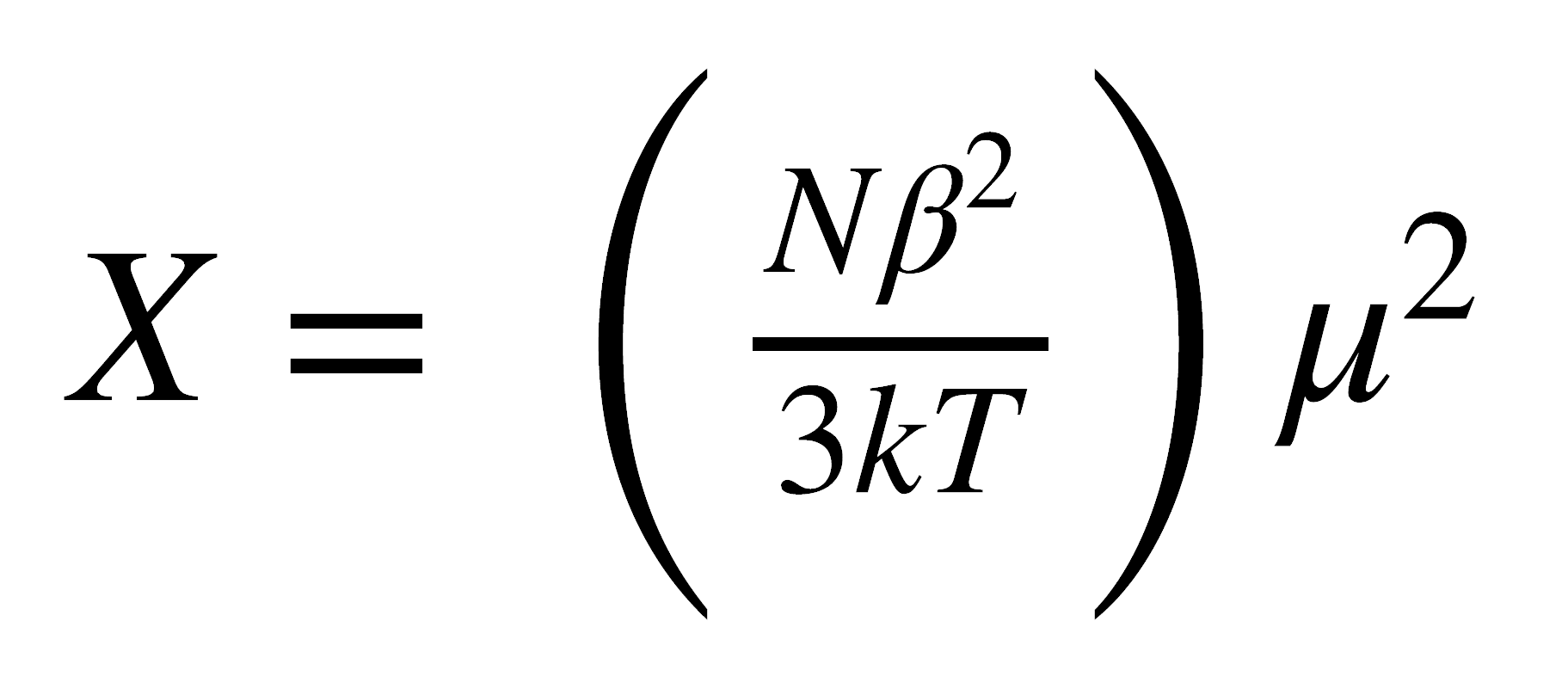
donde N es el número de Avogadro, k es la Constante de Boltzmann y T es la temperatura absoluta.
La ecuación anterior relaciona la susceptibilidad magnética con la temperatura. Cuando una sustancia paramagnética se coloca en un campo magnético los momentos de las moléculas o iones paramagnéticos tienden a alinearse con el campo, Sin embargo, la agitación térmica hace orientar al azar los momentos individuales, lo cual ocasiona una disminución de la susceptibilidad magnética con el aumento de la temperatura.
Cuando el átomo o ion es parte de un complejo puede ocurrir la supresión del momento angular orbital, debido a que la contribución de éste al momento magnético es mínima por las interacciones de los electrones con sus alrededores no esféricos. Esta supresión es importante para los complejos de los metales de la primera serie de transición, pero no es aplicable a los de la segunda y tercera series de transición.
En un compuesto de coordinación hay contribución del momento angular orbital al momento magnético cuando existe al menos un orbital vacío o semilleno, de energía similar a los que tienen los electrones desapareados. Cuando esto sucede los electrones pueden usar este orbital disponible para circular alrededor del centro del complejo y por lo tanto generar un momento angular y un momento magnético. En términos de simetría, debe existir un orbital disponible relacionado con el orbital ocupado por una rotación alrededor del eje z que sea operación de simetría del compuesto y no contenga un electrón con el mismo espín que el del orbital ocupado.
Entonces, en una primera aproximación, se puede considerar que μ se debe únicamente al espín y ley de Curie puede rescribirse así:
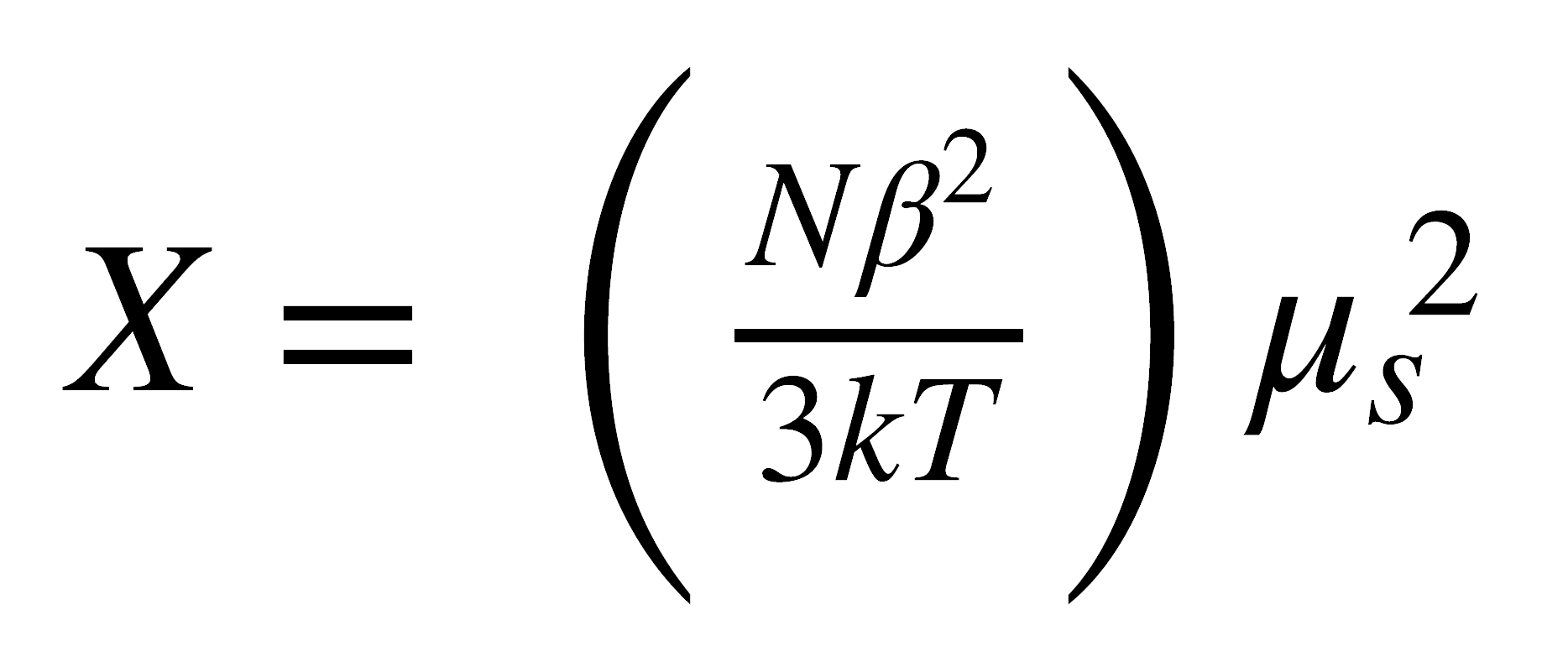
de donde:
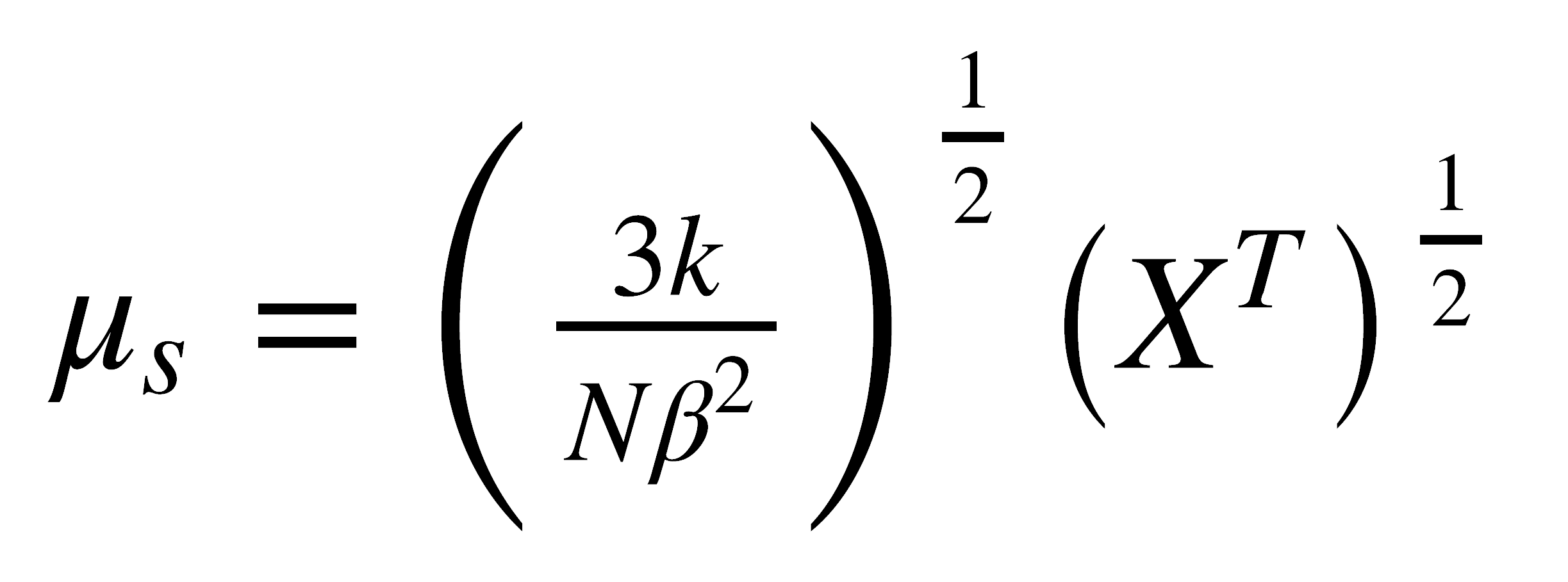
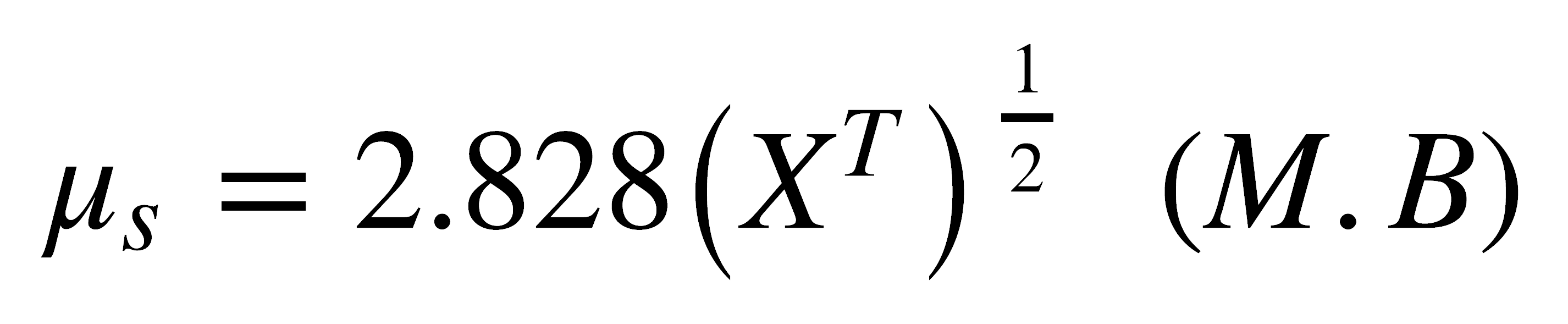
El momento magnético puede entonces calcularse en una forma aproximada a partir de la ecuación:
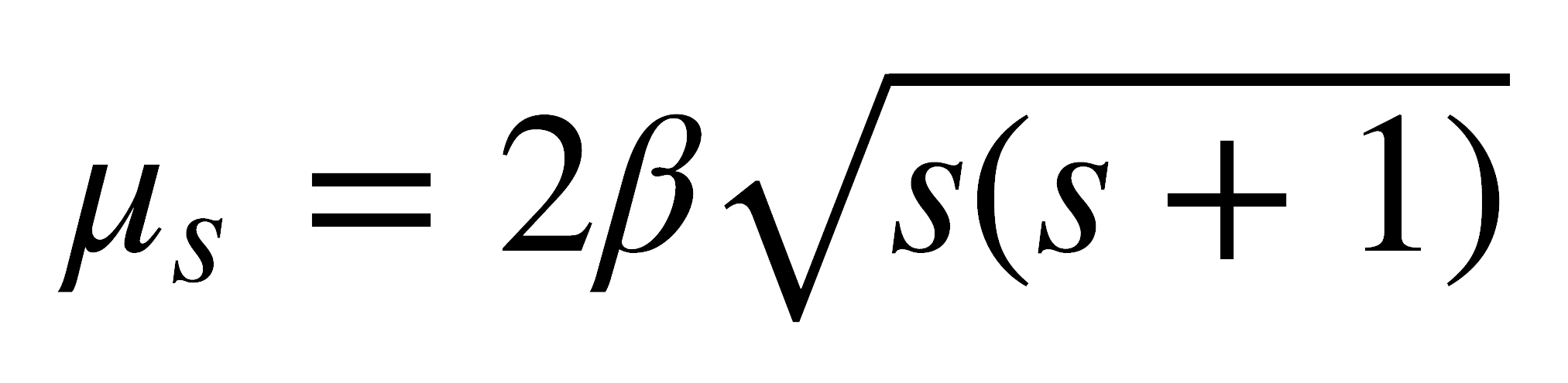
Al expresar ms en magnetones de Bohr (M.B), b = 1, entonces:
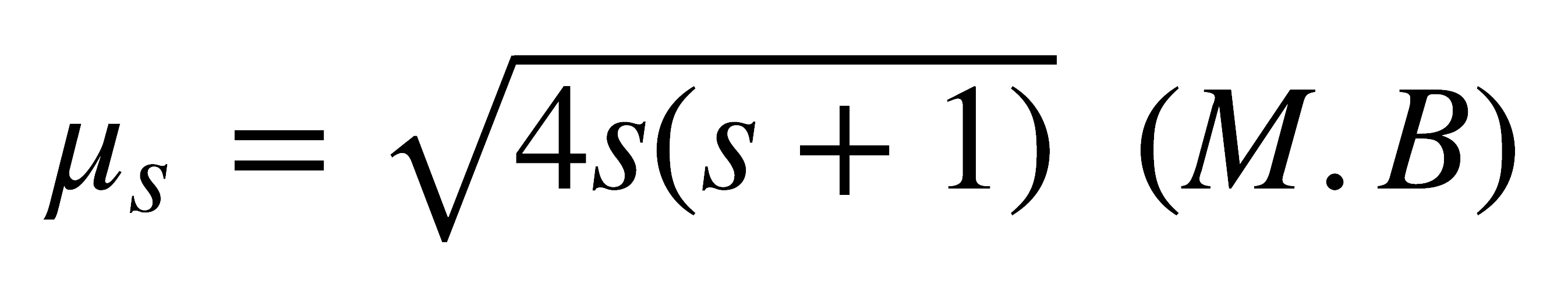
Como s = n/2, donde n es el número de electrones desapareados, entonces ms puede escribirse como:
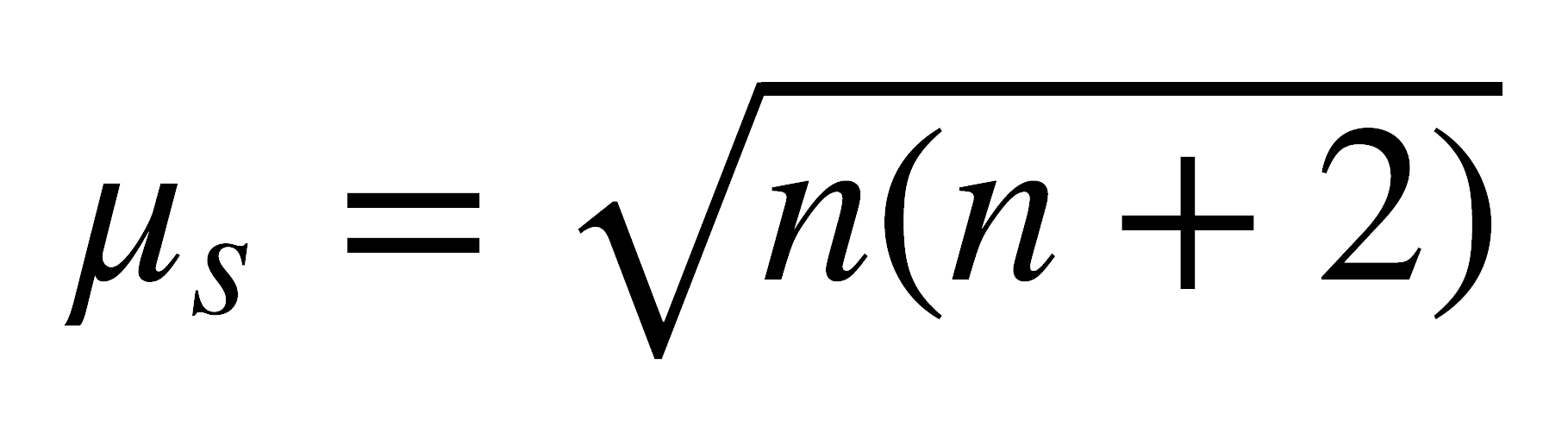
Cooperación de efectos magnéticos
Hasta el momento se han discutido las propiedades magnéticas suponiendo que cada átomo está aislado dentro de una molécula o un cristal, de manera que no sufre influencia de otros átomos paramagnéticos. Cuando esto ocurre, se dice que el sistema está "magnéticamente diluido".
Sin embargo, en algunos casos las interacciones con otros sistemas paramagnéticos pueden causar desviaciones en el comportamiento discutido hasta ahora. Estas interacciones pueden ocurrir a través de ligantes tales como S2- u O2- o a través del espacio. Con base en esto, se conocen tres tipos de magnetismo cooperativo:
-
Ferromagnetismo: la interacción magnética hace que los espines de los diferentes centros metálicos se alineen en forma paralela, haciendo que el momento magnético neto sea muy grande y la sustancia lo presente en forma espontánea. Este fenómeno ocurre en las sustancias usadas como imanes permanentes, por ejemplo CrO2. El ferromagnetismo se presenta en sustancias que tienen electrones desapareados en orbitales d o f, que se acoplan con electrones desapareados que se encuentran en orbitales similares de átomos vecinos.
-
Antiferromagnetismo: En una sustancia antiferromagnética (por ejemplo el MnO) los espines se alinean en forma antiparalela y la sustancia tiene un momento magnético bajo o nulo. El acoplamiento de los espines responsable del antiferromagnetismo ocurre por lo general a través de ligantes del tipo S u O, a través de un mecanismo que se conoce como superintercambio.
-
Ferrimagnetismo: (por ejemplo en el Fe3O4) se observa también un ordenamiento magnético antiparalelo pero los momentos magnéticos provienen de iones con momentos individuales diferentes y por lo tanto no hay cancelación completa de éstos; el resultado es la existencia de un momento magnético neto. Las interacciones que originan este fenómeno también se transmiten generalmente a través de ligantes.
Los diferentes tipos de magnetismo pueden representarse esquemáticamente en esta forma:
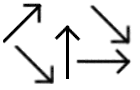
Paramagnetismo
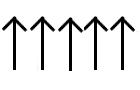
Ferromagnetismo
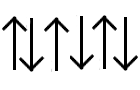
Antiferromagnetismo
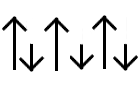
Ferrimagnetismo
Los varios tipos de comportamiento magnético pueden reconocerse por su dependencia de la temperatura, la cual se ilustra a continuación:

Variación de la susceptibilidad magnética con la temperatura
En sustancias en las cuales que presentan efectos magnéticos cooperativos, la dependencia de la susceptibilidad magnética con la temperatura se expresa más apropiadamente por la ley de Curie-Weiss:
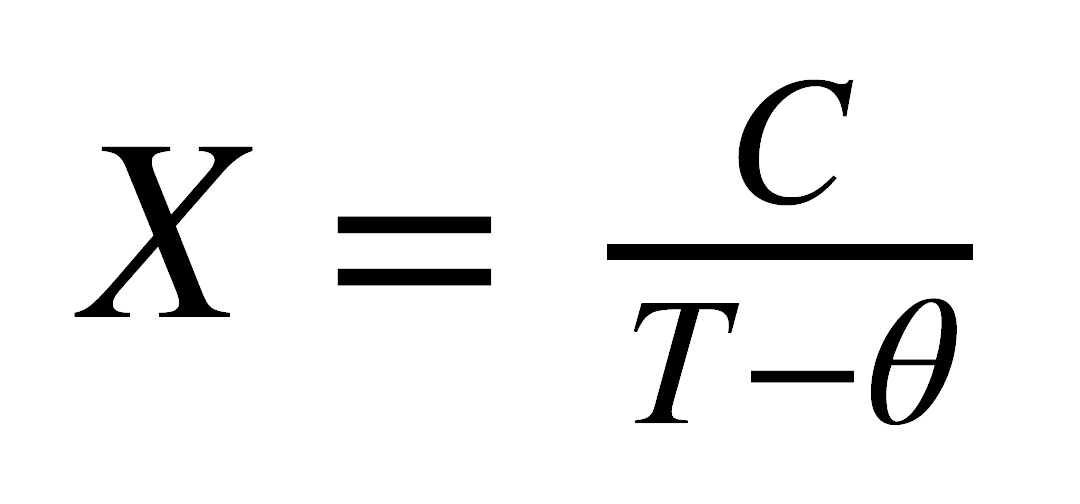
donde q es una constante con unidades de temperatura. De acuerdo con esta ley la sustancia paramagnética muestra una dependencia inversa entre c y T. La sustancia ferromagnética, a altas temperaturas, muestra un comportamiento paramagnético, pero por debajo de una cierta temperatura, llamada la temperatura Curie (Tc) el aumento de con la disminución de temperatura es mayor. En una sustancia antiferromagnética, por debajo de la temperatura de Neel (TN) se observa una disminución de c al disminuir la temperatura. Por el contrario, en las sustancias diamagnéticas la susceptibilidad es independiente de la temperatura.